Les systèmes actuels de capture du carbone souffrent d’un compromis entre l’efficacité de la capture et de la libération, mais une nouvelle approche mise au point au MIT peut accroître l’efficacité globale.
L’élimination efficace du dioxyde de carbone de l’atmosphère est souvent considérée comme une nécessité cruciale pour lutter contre le changement climatique, mais les systèmes d’élimination du dioxyde de carbone souffrent d’un compromis. Les composés chimiques qui éliminent efficacement le CO₂ de l’air ne le libèrent pas facilement une fois capturé, et les composés qui libèrent efficacement le CO₂ ne sont pas très efficaces pour le capturer. L’optimisation d’une partie du cycle tend à aggraver l’autre partie.
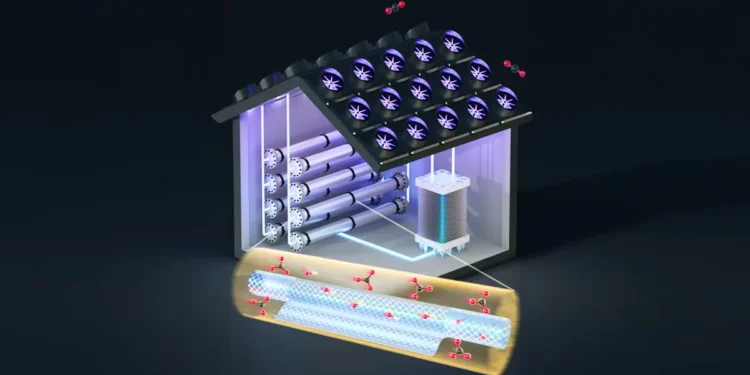
Aujourd’hui, en utilisant des membranes filtrantes à l’échelle nanométrique, des chercheurs du MIT ont ajouté une étape intermédiaire simple qui facilite les deux parties du cycle. Cette nouvelle approche pourrait permettre de multiplier par six l’efficacité de la capture et de la libération électrochimiques du dioxyde de carbone et de réduire les coûts d’au moins 20 %, affirment-ils.
Ces nouvelles découvertes sont publiées dans la revue ACS Energy Letters, dans un article rédigé par Simon Rufer, Tal Joseph et Zara Aamer, doctorants au MIT, et Kripa Varanasi, professeur de génie mécanique.
« Nous devons penser à l’échelle dès le départ lorsqu’il s’agit de capturer le carbone, car pour avoir un impact significatif, il faut traiter des gigatonnes de CO₂ », indique Kripa Varanasi. « Cet état d’esprit nous aide à repérer les goulets d’étranglement critiques et à concevoir des solutions innovantes ayant un réel potentiel d’impact. C’est la force motrice de notre travail. »
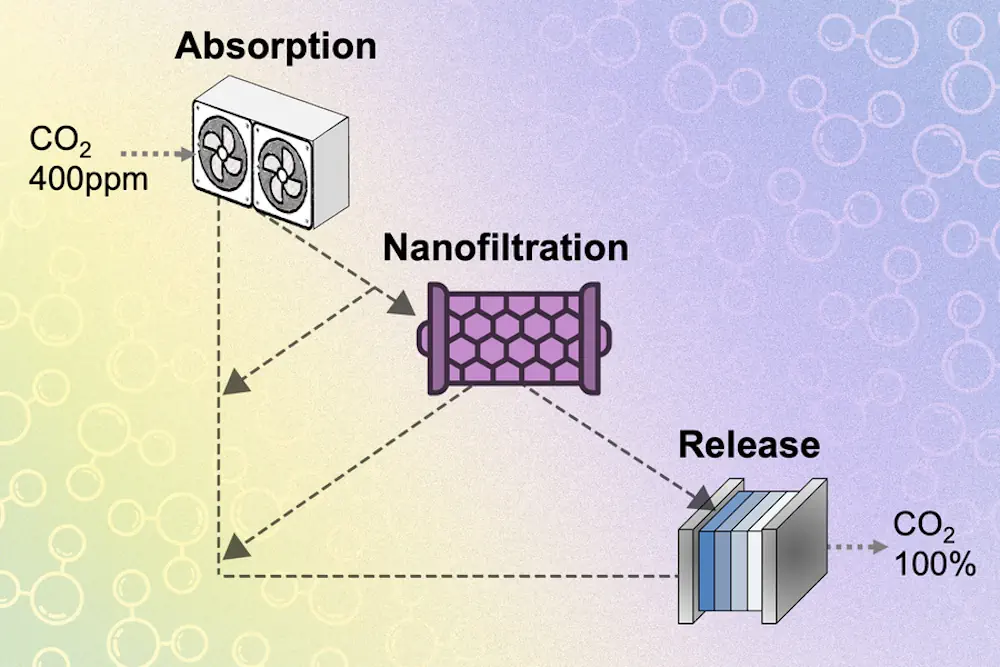
De nombreux systèmes de capture du carbone utilisent des produits chimiques appelés hydroxydes, qui se combinent facilement avec le dioxyde de carbone pour former du carbonate. Ce carbonate est introduit dans une cellule électrochimique, où il réagit avec un acide pour former de l’eau et libérer du dioxyde de carbone. Le processus peut utiliser de l’air ordinaire contenant seulement 400 parties par million de dioxyde de carbone et générer un flux de dioxyde de carbone pur à 100 %, qui peut ensuite être utilisé pour fabriquer des carburants ou d’autres produits.
Les deux étapes de capture et de libération fonctionnent dans la même solution à base d’eau, mais la première étape nécessite une solution à forte concentration d’ions hydroxyde, et la seconde une solution à forte concentration d’ions carbonate. « Vous pouvez constater que ces deux étapes sont contradictoires », explique M. Varanasi. « Ces deux systèmes font circuler le même sorbant dans les deux sens. Ils utilisent exactement le même liquide. Mais comme ils ont besoin de deux types de liquides différents pour fonctionner de manière optimale, il est impossible de faire fonctionner les deux systèmes à leur point le plus efficace ».
La solution de l’équipe a consisté à découpler les deux parties du système et à en introduire une troisième entre les deux. Essentiellement, une fois que l’hydroxyde de la première étape a été converti chimiquement en carbonate, des membranes de nanofiltration spéciales séparent les ions de la solution en fonction de leur charge. Les ions carbonate ont une charge de 2, tandis que les ions hydroxyde ont une charge de 1. « La nanofiltration est capable de séparer ces deux types d’ions assez bien », explique M. Rufer.
Une fois séparés, les ions hydroxyde sont renvoyés vers le côté absorption du système, tandis que les carbonates sont envoyés vers l’étape de libération électrochimique. De cette manière, les deux extrémités du système peuvent fonctionner de manière plus efficace. M. Varanasi explique qu’au cours de l’étape de libération électrochimique, des protons sont ajoutés au carbonate pour provoquer la conversion en dioxyde de carbone et en eau, mais si des ions hydroxyde sont également présents, les protons réagiront avec ces ions et ne produiront que de l’eau.
« Si l’on ne sépare pas les hydroxydes et les carbonates », précise M. Rufer, « le système échoue parce que l’on ajoute des protons à l’hydroxyde au lieu du carbonate, et l’on se contente donc de produire de l’eau au lieu d’extraire du dioxyde de carbone. C’est là que l’efficacité est perdue. L’utilisation de la nanofiltration pour éviter cela était quelque chose que personne, à notre connaissance, n’avait proposé auparavant ».
Les tests ont montré que la nanofiltration pouvait séparer le carbonate de la solution d’hydroxyde avec une efficacité d’environ 95 %, validant ainsi le concept dans des conditions réalistes, explique M. Rufer. L’étape suivante consistait à évaluer l’effet de cette séparation sur l’efficacité et l’économie globales du processus. Les chercheurs ont créé un modèle technico-économique intégrant l’efficacité électrochimique, la tension, le taux d’absorption, les coûts d’investissement, l’efficacité de la nanofiltration et d’autres facteurs.
L’analyse a montré que les systèmes actuels coûtent au moins 600 dollars par tonne de dioxyde de carbone capturé, alors qu’avec l’ajout de la composante de nanofiltration, ce coût tombe à environ 450 dollars par tonne. De plus, le nouveau système est beaucoup plus stable, continuant à fonctionner avec une grande efficacité même en cas de variations des concentrations d’ions dans la solution. « Dans l’ancien système sans nanofiltration, on fonctionne en quelque sorte sur le fil du rasoir », ajoute M. Rufer ; si la concentration varie même légèrement dans un sens ou dans l’autre, l’efficacité chute radicalement. « Mais avec notre système de nanofiltration, il agit comme une sorte de tampon et devient beaucoup plus indulgent. Vous disposez d’un régime opérationnel beaucoup plus large et vous pouvez obtenir des coûts nettement inférieurs ».
Il ajoute que cette approche pourrait s’appliquer non seulement aux systèmes de capture directe de l’air qu’ils ont étudiés spécifiquement, mais aussi aux systèmes à source ponctuelle – qui sont attachés directement aux sources d’émissions telles que les émissions des centrales électriques – ou à l’étape suivante du processus, la conversion du dioxyde de carbone capturé en produits utiles tels que le carburant ou les matières premières chimiques. Ces processus de conversion, ajoute-t-il, « ils sont également bloqués par ce compromis entre le carbonate et l’hydroxyde ».
En outre, cette technologie pourrait déboucher sur des produits chimiques alternatifs plus sûrs pour la capture du carbone, explique M. Varanasi. « Beaucoup de ces absorbants peuvent parfois être toxiques ou nocifs pour l’environnement. En utilisant un système comme le nôtre, on peut améliorer le taux de réaction, ce qui permet de choisir des produits chimiques qui n’ont peut-être pas le meilleur taux d’absorption au départ, mais qui peuvent être améliorés pour assurer la sécurité. »
M. Varanasi ajoute que « ce qui est vraiment bien, c’est que nous avons pu le faire avec ce qui est disponible dans le commerce et avec un système qui peut facilement être installé sur des installations de capture du carbone existantes. Si les coûts peuvent encore être ramenés à environ 200 dollars la tonne, il pourrait être viable de l’adopter à grande échelle. Grâce aux travaux en cours, « nous sommes convaincus que nous aurons quelque chose d’économiquement viable et que nous pourrons fabriquer des produits de valeur commercialisables. »
M. Rufer fait remarquer qu’aujourd’hui encore, « les gens achètent des crédits de carbone à un prix supérieur à 500 dollars la tonne. Donc, au coût que nous prévoyons, c’est déjà commercialement viable en ce sens qu’il y a des acheteurs qui sont prêts à payer ce prix ». Mais en abaissant encore le prix, cela devrait augmenter le nombre d’acheteurs qui envisageraient d’acheter le crédit, commente-t-il. « Il s’agit simplement de savoir jusqu’à quel point nous pouvons le généraliser. »
Conscient de cette demande croissante du marché, M. Varanasi déclare : « Notre objectif est de fournir à l’industrie des technologies et des systèmes évolutifs, rentables et fiables qui lui permettent d’atteindre directement ses objectifs de décarbonation. »
Source : MIT