Une analyse expérimentale détaillée révèle les mécanismes décisifs qui régissent la cinétique ionique au niveau des électrodes négatives en carbone dur.
L’impulsion mondiale pour la durabilité nécessite des batteries meilleures et plus durables pour soutenir les systèmes d’énergie renouvelable et nos appareils électroniques omniprésents. Si les batteries lithium-ion (LIB) sont actuellement la solution privilégiée, l’avenir appelle à des alternatives construites à partir de matériaux plus largement disponibles que le lithium. Le sodium étant abondant et disponible à faible coût, les batteries sodium-ion (SIB) sont un candidat de premier plan pour remplacer les LIB tout en répondant aux demandes énergétiques mondiales.
La clé des performances remarquables des SIB réside en partie dans le matériau utilisé à l’électrode négative, appelé carbone dur (HC). Ce type de carbone peu cristallin et poreux peut stocker de grandes quantités de sodium, permettant aux SIB d’atteindre des densités d’énergie comparables aux LIB commerciales. Bien que les scientifiques pensent que le HC est un matériau à charge rapide, le prouver expérimentalement est un défi. Le problème est que les tests conventionnels de batteries sous-estiment souvent le taux de charge réel du matériau en raison de problèmes de surtension de concentration dans l’électrode composite. En termes simples, lors d’une charge rapide, la structure composite dense de l’électrode peut provoquer des embouteillages ioniques, où le transport des ions dans l’électrolyte limite la vitesse de réaction. Ainsi, la limite fondamentale du taux de charge du HC, ainsi que la façon dont le taux d’insertion du sodium se compare à celui du lithium, restent flous.
Pour combler cette lacune de connaissances, une équipe de recherche dirigée par le professeur Shinichi Komaba, aux côtés de M. Yuki Fujii, doctorant de troisième année, et du professeur assistant Zachary T. Gossage du Département de chimie appliquée de l’Université des sciences de Tokyo, au Japon, a employé une approche innovante pour découvrir les limites cinétiques de l’insertion du sodium et du lithium dans le HC.
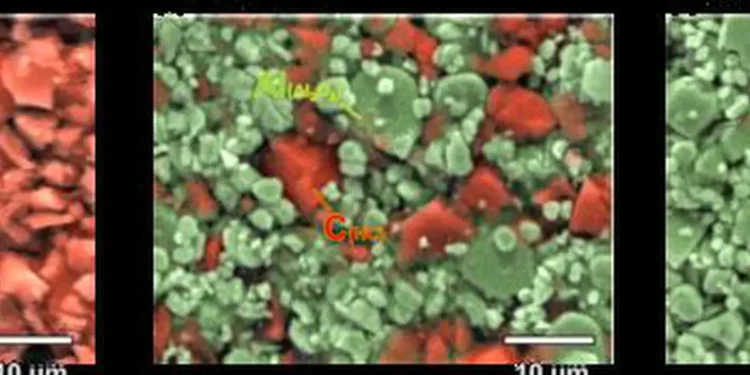
Les chercheurs ont utilisé une technique connue sous le nom de méthode d’électrode diluée.*1 Elle consiste à créer une électrode qui combine à la fois des particules de HC et un matériau électrochimiquement inactif comme l’oxyde d’aluminium. Au ratio approprié, elle garantit que chaque particule de HC est entourée d’un approvisionnement abondant en ions, éliminant les problèmes typiques de transport ionique au sein de l’électrolyte et à l’électrode négative. En utilisant cette approche, les chercheurs ont pu mesurer et comparer très efficacement les taux maximums de sodation (insertion de sodium), d’intercalation du lithium et de lithiation (insertion de lithium) dans le HC. De plus, la sodation dans l’électrode de HC dilué a montré une capacité de taux comparable à l’intercalation du lithium dans les électrodes de graphite dilué.
Nos résultats ont fourni des preuves claires et quantitatives du potentiel à haut débit du HC. Grâce à des tests et analyses détaillés utilisant la voltampérométrie cyclique, la spectrométrie d’impédance électrochimique et la chronoampérométrie par palier de potentiel, l’équipe a constaté que le processus de sodation est intrinsèquement plus rapide que la lithiation pour la même électrode négative. Cela a été confirmé en calculant le coefficient de diffusion apparent — une mesure de la rapidité avec laquelle les ions se déplacent dans le matériau — qui était généralement plus élevé pour le sodium que pour le lithium. « Nos résultats démontrent quantitativement que la vitesse de charge d’une SIB utilisant une anode en HC peut atteindre des taux plus rapides que celle d’une LIB », souligne le Pr Komaba.
De plus, l’équipe a précisément identifié que l’étape déterminante pour l’ensemble du processus de charge est le mécanisme de remplissage des pores, qui se produit lorsque les ions s’agrègent pour former des amas pseudo-métalliques dans les nanopores du HC. Bien que l’étape initiale de la charge (adsorption/intercalation) se soit révélée très rapide pour les deux ions, la vitesse de la réaction totale est finalement limitée par l’efficacité du processus de remplissage des pores.
Une analyse cinétique chimique détaillée a révélé que le sodium nécessite moins d’énergie que le lithium pour former ces amas, ce qui aide à expliquer les avantages de vitesse observés. En identifiant ce goulot d’étranglement, cette étude fournit une orientation claire pour des conceptions de batteries plus rapides et plus écoénergétiques. « Un point clé pour développer des matériaux HC améliorés pour des SIB à charge rapide est d’obtenir une cinétique plus rapide du processus de remplissage des pores afin qu’ils puissent être accessibles à des taux de charge élevés. De plus, nos résultats suggèrent que l’insertion du sodium est moins sensible à la température, en considérant une énergie d’activation plus faible que pour la lithiation », explique le Pr Komaba.
Les résultats de ce travail nous indiquent que les SIB ne sont pas simplement une alternative moins chère et plus sûre aux LIB, mais qu’elles offrent de véritables avantages de performance en termes de vitesse de charge, particulièrement pertinents dans les applications à haute puissance. De plus, les SIB pourraient offrir un fonctionnement plus stable que les LIB. D’autres études pour perfectionner les SIB ouvriront lentement mais sûrement la voie à de nouvelles technologies de batteries, soutenant les efforts actuels pour construire des sociétés durables.
* 1 Méthode d’électrode diluée
Cette méthode électrochimique unique et efficace pour évaluer la cinétique des matériaux d’insertion a été initialement développée par le professeur associé Kingo Ariyoshi de l’Université métropolitaine d’Osaka. Dans cette recherche, le matériau actif de l’électrode négative, c’est-à-dire la poudre de HC, a été partiellement remplacé par de la poudre d’oxyde d’aluminium, qui est électrochimiquement inactive.
Article : Revealing the Kinetic Limits of Sodiation and Lithiation at Hard Carbon Using the Diluted Electrode Method – Journal : Chemical Science – Méthode : Experimental study – DOI : Lien vers l’étude
Source : Tokyo U.