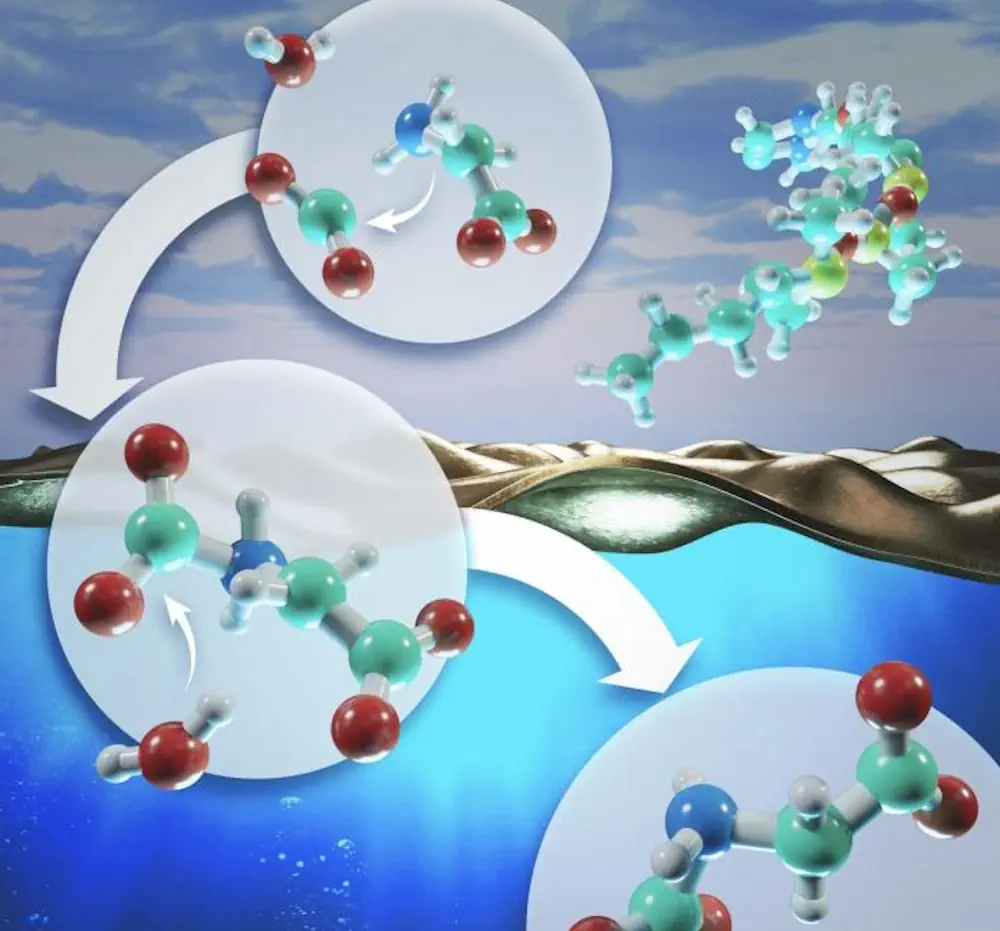
À l’aide du supercalculateur Summit, désormais hors service, les chercheurs du laboratoire national d’Oak Ridge du département américain de l’Énergie ont réalisé les simulations de dynamique moléculaire les plus importantes et les plus précises à ce jour sur l’interface entre l’eau et l’air lors d’une réaction chimique. Ces simulations ont permis de découvrir comment l’eau contrôle ces réactions chimiques en se couplant dynamiquement avec les molécules impliquées dans le processus.
Cette nouvelle compréhension du rôle de l’eau pourrait aider les chercheurs à développer des méthodes pour accélérer les réactions chimiques à l’interface, ce qui pourrait augmenter leur efficacité et leur productivité dans les processus industriels. Plus précisément, l’équipe de la division des sciences chimiques de l’ORNL a étudié une réaction de substitution nucléophile bimoléculaire, connue sous le nom de SN2. La SN2 est l’un des mécanismes les plus courants en chimie, physique, biologie et chimie atmosphérique. Par exemple, les réactions SN2 sont essentielles dans la synthèse des médicaments et étaient autrefois utilisées dans la production d’ibuprofène.
« Il s’agit du premier article qui répond à la question suivante : Quel est le rôle dynamique de l’interface air-eau dans la modulation de la vitesse des réactions chimiques ? », a indiqué Vyacheslav Bryantsev, responsable du groupe Séparations chimiques de l’ORNL et coauteur de l’étude, publiée dans le Journal of the American Chemical Society. « Nous confirmons dans cette étude que la vitesse de réaction globale à l’interface air-eau devient plus rapide par rapport à la vitesse de réaction dans l’environnement principal constitué uniquement d’eau. »
Les simulations de l’équipe indiquent que les réactions chimiques impliquant l’eau et l’air pourraient être accélérées en retirant les molécules en interaction de l’environnement massif de l’eau (c’est-à-dire profondément dans l’eau, loin de l’interface) et en les rapprochant de sa surface, où l’air et l’eau interagissent. Il en résulte une réduction du couplage dynamique de l’eau avec ces molécules, ce qui permet à la réaction chimique de se dérouler avec moins d’interférences.
On s’attend à ce que l’eau influence la vitesse des réactions puisqu’elle sert de médiateur à la réaction, mais on ignorait dans quelle mesure et comment l’eau contrôle la réaction.
« Nous avons découvert que plus les molécules d’eau se couplent, plus elles entravent les réactions. Si nous pouvons réduire ce couplage dynamique, nous obtiendrons une vitesse de réaction plus rapide », a ajouté Santanu Roy, scientifique au sein du groupe Carbone et Composites de l’ORNL et coauteur de l’étude. « Notre étude suggère que si nous pouvons contrôler ce couplage en modifiant l’environnement à l’interface, c’est-à-dire la manière dont l’eau affecte les réactions, nous devrions alors être en mesure de contrôler la vitesse de réaction. »
À l’aide du code open source CP2K, l’équipe de l’ORNL a modélisé les trajectoires de réaction des molécules sur le supercalculateur Summit. Elle a ensuite procédé à une analyse cinétique de ces trajectoires afin d’établir un profil énergétique du processus.
« Nos théories n’auraient pas pu être validées ou étudiées sans une puissance de calcul de pointe », a commenté Santanu Roy. « Nous devions exécuter des milliers de trajectoires, pour chaque point de ce profil énergétique. Nous avons dû effectuer de nombreuses simulations au niveau électronique, ce qui prend beaucoup de temps, et nous avons dû les exécuter toutes en parallèle. Sans Summit, cela aurait été impossible. »
Sur la base de travaux expérimentaux antérieurs qui ont montré que les molécules tensioactives chargées positivement attirent les acides aminés chargés négativement, les chercheurs ont simulé un tel tensioactif afin d’attirer davantage d’acides aminés dans l’interface et ont confirmé une augmentation du taux de réaction de 10 % à 15 %. L’étude de l’équipe de l’ORNL a montré que lorsqu’un gaz réagit avec des acides aminés, il passe par des cycles de couplage dynamique répétés avec les molécules d’eau, ce qui ralentit la réaction chimique avant de finalement se transformer en un nouveau produit.
« Le défi consistait ici à comprendre le rôle de l’eau et la manière dont elle contrôle les vitesses de réaction et leurs voies, c’est-à-dire le mécanisme. Pour ce faire, nous devions vraiment comprendre la voie de réaction. C’est là que Summit est intervenu et nous a beaucoup aidés. »
Article : « The Role of Nonequilibrium Solvent Effects in Enhancing Direct CO2 Capture at the Air–Aqueous Amino Acid Interface » – DOI : 10.1021/jacs.4c14612