La Food and Drug Administration (FDA) américaine vient de suspendre l’autorisation de mise sur le marché d’IXCHIQ®, le premier vaccin contre le chikungunya développé par la biotech franco-autrichienne Valneva. Au cœur de la décision : quatre nouveaux cas d’effets indésirables graves, jugés suffisamment préoccupants pour interrompre immédiatement ventes et expéditions outre-Atlantique. La société, qui défend l’innocuité de son produit, se retrouve contrainte de négocier avec le régulateur au moment où le virus poursuit son expansion mondiale.
Une volte-face réglementaire éclair
Le 6 août, la FDA levait déjà une pause temporaire imposée au vaccin chez les plus de 60 ans, après un examen d’événements indésirables survenus dans cette tranche d’âge. Moins de trois semaines plus tard, l’agence fait machine arrière : quatre nouveaux signalements graves, issus du système de pharmacovigilance VAERS, dont trois chez des patients de 70 à 82 ans et un à 55 ans, ont suffi pour déclencher la suspension de licence.
Cette décision entraîne l’arrêt immédiat de la distribution américaine, principal débouché commercial visé par Valneva. L’entreprise souligne que les symptômes observés « s’apparentent » à ceux déjà décrits lors des essais cliniques et restent majoritairement cantonnés aux personnes âgées polypathologiques.
Le titre de Valneva chahuté à la bourse
IXCHIQ® n’avait encore généré que 7,5 millions d’euros de ventes sur les 91 millions enregistrés par Valneva au premier semestre 2025, gonflées par une livraison exceptionnelle destinée à l’épidémie à La Réunion. Le produit était cependant appelé à devenir un relais de croissance clé, avant même l’arrivée potentielle, en 2028, du vaccin contre la maladie de Lyme codéveloppé avec Pfizer.
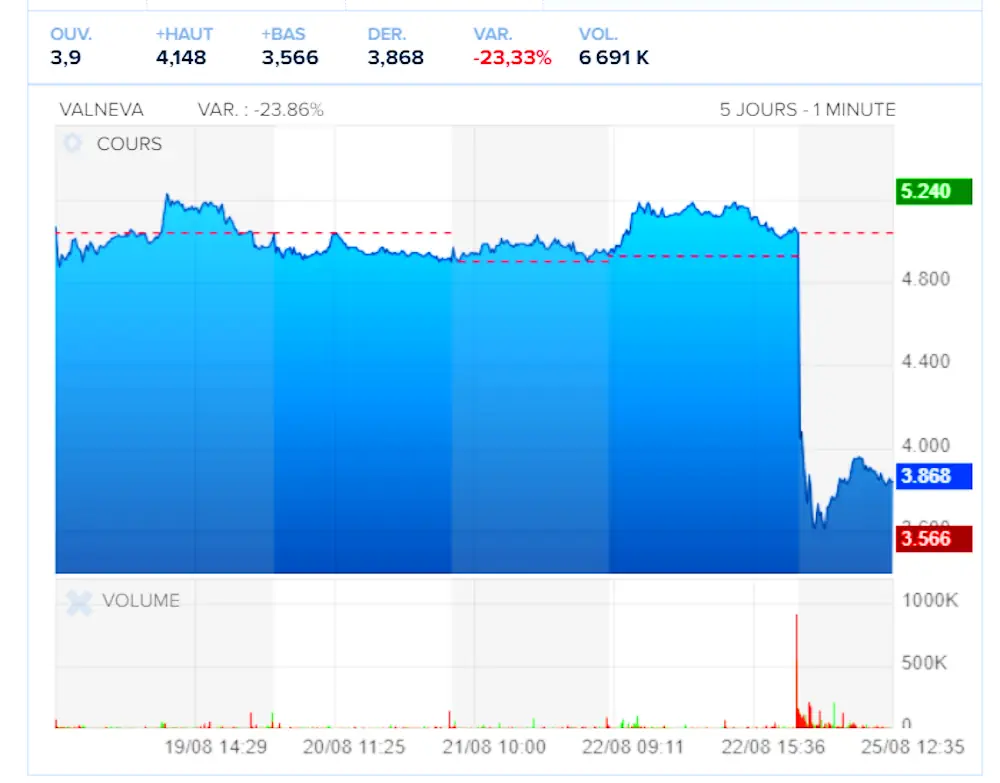
Pour l’heure, la société ne révise pas son objectif de chiffre d’affaires annuel, mais reconnaît qu’un retrait définitif aux États-Unis pourrait peser lourd sur ses perspectives. Les analystes suivront de près la durée de la suspension, la capacité de Valneva à fournir des données rassurantes et l’attitude des autres autorités sanitaires, notamment en Europe et en Amérique latine où le produit est autorisé.
Un risque sanitaire toujours présent
Le chikungunya, transmis par les moustiques Aedes, provoque fièvre et arthralgies invalidantes pouvant durer plusieurs années. Depuis 2004, le virus s’est implanté dans plus de 110 pays. L’Organisation mondiale de la santé classe la maladie parmi les principales menaces émergentes pour la santé publique. Dans ce contexte, Valneva insiste sur la nécessité de maintenir l’accès à IXCHIQ® dans les régions endémiques, en particulier les pays à revenu faible ou intermédiaire où aucune alternative vaccinale n’existe.
Quelles issues possibles ?
Trois scénarios se dessinent :
- Une négociation rapide avec la FDA aboutissant à une reprise de la commercialisation, assortie de nouvelles restrictions d’usage ou d’un étiquetage renforcé.
- Une prolongation de la suspension, le temps pour Valneva de fournir des analyses supplémentaires, retardant le déploiement alors que la saison des voyages dans les Caraïbes approche.
- Un retrait définitif, obligeant la biotech à redéployer ses ressources vers son portefeuille de candidats vaccins et à rechercher de nouveaux relais de revenus.
En suspendant IXCHIQ®, la FDA envoie un signal de prudence dans un domaine où la tolérance au risque est limitée. Pour Valneva, l’enjeu dépasse la seule courbe de ventes : il s’agit de démontrer la robustesse de sa surveillance post-commercialisation et de préserver la confiance des autorités comme des investisseurs. À l’heure où le chikungunya progresse et où les moustiques vecteurs gagnent du terrain dans l’hémisphère Nord, la course au premier vaccin efficace et sûr reste ouverte.
Source : Valneva