Le bioprinting, ou l’impression de cellules et de tissus vivants, est une technique prometteuse qui pourrait résoudre le problème de la pénurie de donneurs d’organes en cultivant des organes à partir des propres cellules des patients. Cependant, imprimer des tissus et des cellules vivantes est extrêmement compliqué et de nombreux obstacles doivent être surmontés pour y parvenir.
Cet article met en lumière trois innovations récentes de l’UMC Utrecht qui aideront à rendre le bioprinting plus pertinent cliniquement.
L’essor du bioprinting volumétrique
L’impression 3D classique ou l’extrusion de filament plastique sont les premières associations qui viennent à l’esprit lorsqu’on évoque le bioprinting 3D. Mais pour réussir cette prouesse, il faudra créer des tissus hautement détaillés et différenciés : même un millimètre cube de tissu d’organe nécessitera la présence de capillaires sanguins.
L’arrivée des bioencres a rendu possible le bioprinting par extrusion 3D. De nouveaux embouts, des encres nutritives et des échafaudages préfabriqués facilitent la survie des cellules durant ce processus. Toutefois, l’impression couche par couche prend encore beaucoup de temps et les cellules risquent de mourir durant ce processus.
Pour pallier ce processus lent et dépendant de la gravité, le bioprinting volumétrique a également été adopté. Dans ce processus, un flacon en rotation contenant un gel spécial est exposé à la lumière laser. Là où la lumière laser frappe, le gel photosensible se solidifie rapidement. Cependant, ces gels photosensibles ne peuvent contenir que des cellules en suspension, il est donc difficile de contrôler quel type de cellule se retrouve où – et combien d’entre elles.
Innovation 1 : Créer des régions fonctionnellement biologiques dans une impression
Le bioprinting volumétrique, qui permet d’imprimer un objet de quelques centimètres en quelques secondes seulement, offre de nombreuses possibilités pour l’impression de cellules. Cependant, lorsque l’impression est terminée, les cellules peuvent ne pas être placées exactement là où elles sont nécessaires.
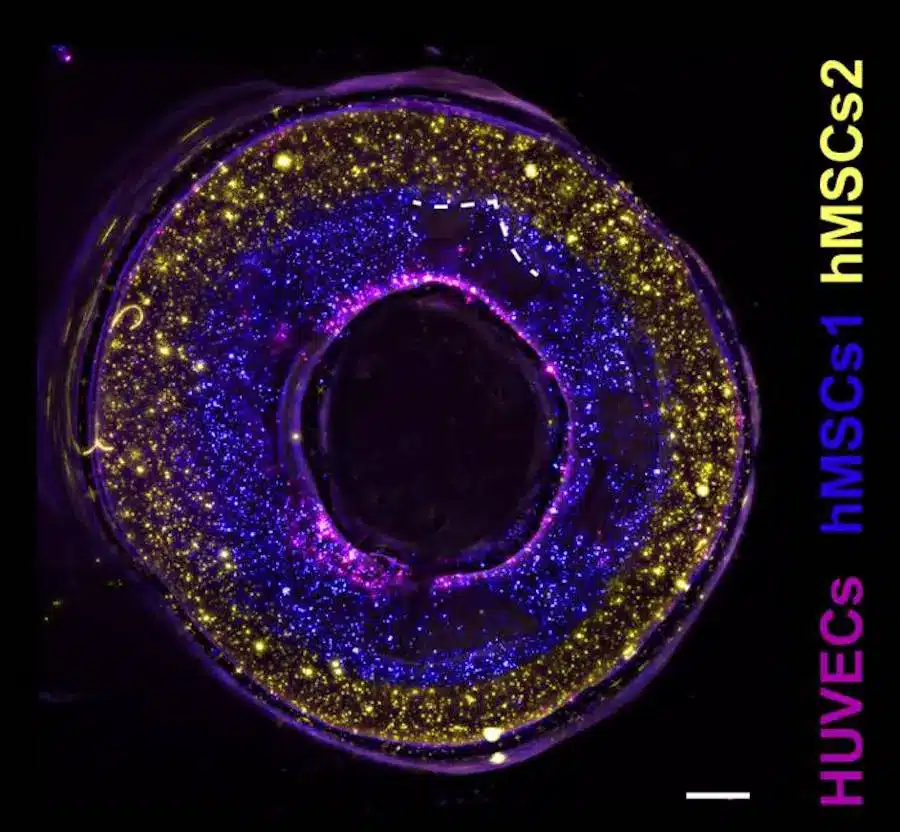
Pour rendre possible des changements chimiques dans l’impression après le processus d’impression initial, les chercheurs ont joué avec la porosité du gel, ainsi qu’avec les composés qui se lient avec d’autres molécules dans le gel. « Avec cette technique, il est possible de greffer des biomolécules sur nos constructions imprimées en quelques minutes seulement, et avec une haute résolution spatiale », explique le premier auteur, Marc Falandt.
Grâce à cette innovation, il est maintenant possible de créer des impressions volumétriques qui peuvent avoir des facteurs de croissance ou des protéines bioactives « peintes » en elles dans n’importe quelle forme 3D souhaitée.
Innovation 2 : Les gels granulaires offrent le meilleur des deux mondes pour les cellules imprimées
Pour un tissu fabriqué avec succès, les cellules imprimées doivent être choyées pour survivre et se développer. Dans le passé, les chercheurs ont utilisé des gels mous pour fournir un environnement favorable aux cellules. Cependant, ces gels manquaient de robustesse et de stabilité, ce qui est nécessaire pour construire des structures 3D plus grandes.
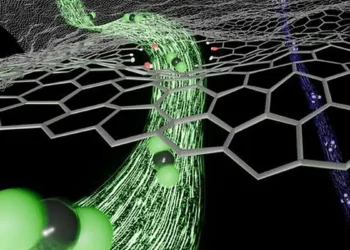
L’équipe de l’UMC Utrecht a développé une nouvelle approche appelée gels granulaires. Ces gels sont composés de particules plus grosses que les mailles du réseau de polymères dans un gel classique. En raison de la taille des particules, elles ne peuvent pas s’échapper du gel. Cela crée un environnement de type « béton liquide » qui peut être facilement remodelé mais devient rigide lorsqu’il est au repos.

Les gels granulaires combinent les avantages des gels mous et durs : ils fournissent un environnement doux pour les cellules et sont assez robustes pour construire des structures 3D de grande taille. En outre, ils peuvent être ajustés pour correspondre aux propriétés mécaniques des tissus du corps humain, ce qui est crucial pour la régénération des tissus.
Innovation 3 : Des bioréacteurs miniaturisés pour le conditionnement des tissus
Une fois que les cellules sont imprimées et placées correctement, elles doivent être maintenues en vie et encouragées à se développer en tissu fonctionnel. Pour ce faire, elles doivent être placées dans un bioreacteur où les conditions peuvent être contrôlées précisément.
Cependant, les bioreacteurs existants sont souvent de grande taille et coûteux. De plus, ils sont souvent conçus pour un seul type de tissu, ce qui les rend peu flexibles. Les chercheurs de l’UMC Utrecht ont donc développé des bioreacteurs miniaturisés qui peuvent être utilisés pour différents types de tissus.
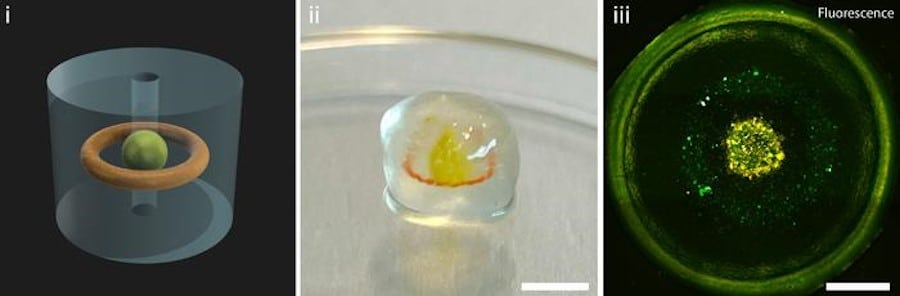
Ces bioreacteurs sont plus petits, moins chers et peuvent être adaptés pour différents types de tissus. De plus, ils peuvent être utilisés pour tester des traitements médicamenteux, ce qui pourrait aider à réduire le besoin d’expérimentation animale.
Ces trois innovations représentent des avancées importantes pour le domaine du bioprinting. Elles permettent de créer des structures de tissus plus précises, de prendre soin des cellules imprimées et de maintenir et développer ces cellules en tissus fonctionnels. Ces progrès rapprochent le bioprinting d’une utilisation clinique réelle.
Illustration principale : Impression de cellules dans un gel granuleux. Crédit / The Levato Lab, UMC Utrecht