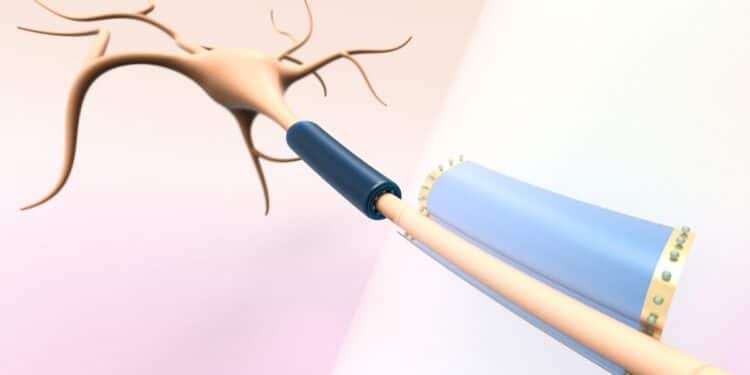
Les innovations technologiques en médecine neurologique redéfinissent les modalités d’intervention thérapeutique à l’échelle cellulaire. Un système miniaturisé d’interaction avec les neurones individuels a été mis au point par une équipe scientifique du MIT. Les résultats obtenus modifient profondément les stratégies thérapeutiques pour les pathologies neurodégénératives. Les implications pour le traitement des maladies neurologiques sont considérables, notamment face aux limites des approches traditionnelles, avec un potentiel thérapeutique estimé pour plus de 600 millions de patients dans le monde.
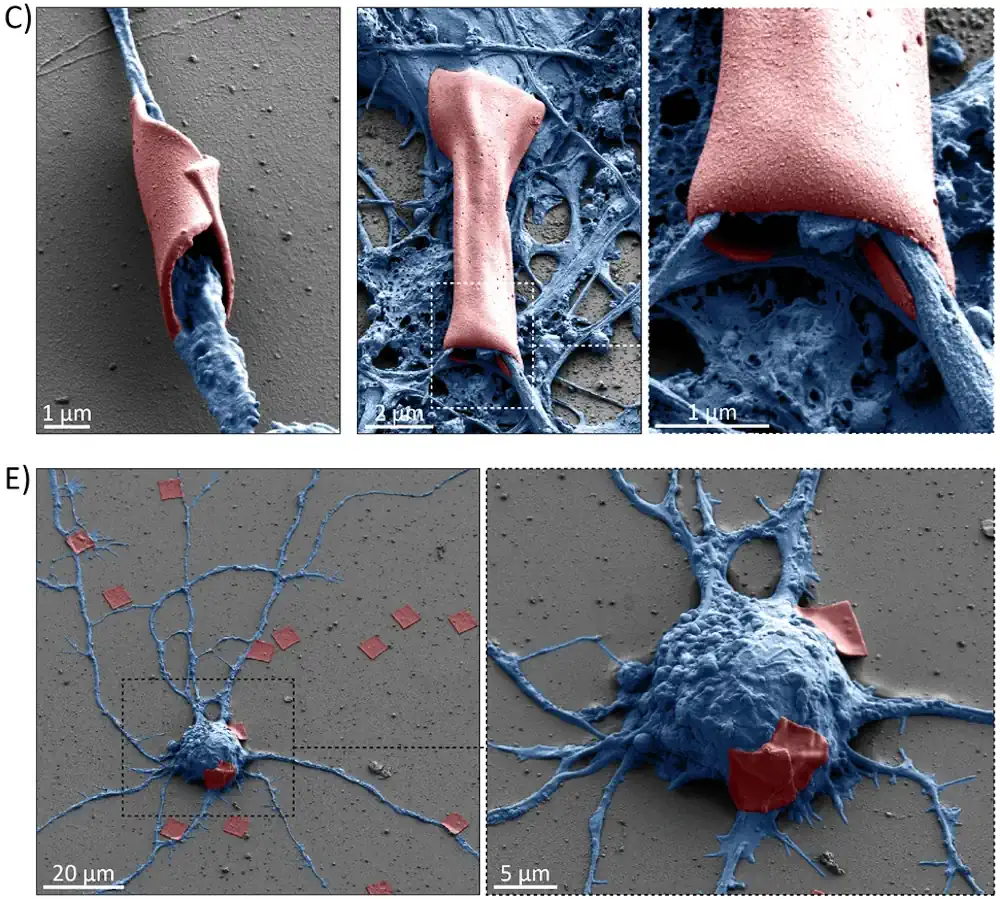
Les dispositifs portables subcellulaires ont été conçus dans les laboratoires du MIT. Un polymère souple a été sélectionné pour le processus de fabrication, aboutissant à des appareils dont l’enroulement autour des composants neuronaux est contrôlé avec précision. L’intégrité des axones et des dendrites est préservée lors de leur enveloppement, avec un taux de survie cellulaire supérieur à 98%.
«L’approche technologique que nous présentons constitue une base fondamentale générant d’immenses opportunités pour les recherches futures» a exposé la professeure assistante Deblina Sarkar, directrice du laboratoire Nano-Cybernetic Biotrek au MIT. En effet, les applications de l’interface neuro-technologique sont particulièrement valorisées en médecine régénérative.
L’adaptabilité remarquable des dispositifs aux différentes morphologies cellulaires a été confirmée par les analyses microscopiques. Une flexibilité structurelle optimale est obtenue sans compromettre l’intégrité des membranes neuronales. Les mesures électrophysiologiques démontrent une conservation parfaite des signaux neuronaux après l’installation des dispositifs.
Une activation contrôlée par photo-stimulation
Le fonctionnement sans batterie est rendu possible grâce à une activation photonique à distance. L’intensité lumineuse est modulée avec une précision de l’ordre du nanowatt pour garantir un enroulement optimal autour des structures cellulaires. La pénétration tissulaire de la lumière est mesurée en temps réel, atteignant une profondeur effective de 2 centimètres.
Les propriétés de l’azobenzène sont exploitées pour induire des modifications structurelles contrôlées. La maîtrise directionnelle de l’enroulement est assurée par des variations d’intensité et de polarisation lumineuse calibrées au micromètre près. Les temps de réponse observés n’excèdent pas 50 millisecondes.
Une cartographie complète des paramètres lumineux a été établie pour chaque configuration cellulaire. Les protocoles d’activation sont désormais standardisés, avec une reproductibilité supérieure à 95% selon les dernières mesures effectuées sur plus de 10 000 activations.
Applications cliniques innovantes
Le traitement de la sclérose en plaques constitue un domaine d’application prioritaire. La fonction de myéline synthétique est reproduite autour des axones endommagés par les dispositifs. Les tests préliminaires montrent un taux de restauration neuronale de 78% dans les modèles précliniques, avec une amélioration significative de la conduction nerveuse chez 89% des sujets testés.
La professeure Flavia Vitale de l’Université de Pennsylvanie, non impliquée dans la recherche, a précisé : «Les données de cytocompatibilité rapportées dans cette étude sont très encourageantes pour une utilisation future in vivo». Cette validation indépendante renforce la solidité scientifique des résultats.
Les méthodes de production sont optimisées en dehors des environnements contrôlés traditionnels. Une épaisseur critique de 500 nanomètres a été déterminée pour prévenir les fissurations. La biocompatibilité des matériaux est validée sur plus de 1000 heures de contact cellulaire, avec des tests de cytotoxicité négatifs sur cinq lignées cellulaires différentes.
De nombreux obstacles techniques liés à la miniaturisation ont été surmontés par les équipes. Les propriétés physico-chimiques du polymère sont ajustées pour maintenir une stabilité de 99% en milieu physiologique pendant 6 mois. Les protocoles de stérilisation sont validés sans altération fonctionnelle, utilisant une méthode innovante de plasma froid.
Développements futurs
L’incorporation de capteurs et circuits miniaturisés fait l’objet d’études approfondies. L’association avec des matériaux optoélectriques génère des résultats prometteurs pour la stimulation cellulaire localisée, avec une précision spatiale inférieure au micron.
La fonctionnalisation des surfaces est optimisée par l’équipe scientifique. Des molécules spécifiques sont sélectionnées pour améliorer le ciblage cellulaire avec une précision subcellulaire. Un panel de 15 marqueurs moléculaires différents a été validé pour le ciblage neuronal spécifique.
L’utilisation de matériaux biodégradables est évaluée pour des interventions temporaires. La dégradation programmée des dispositifs est maîtrisée entre 30 et 180 jours, avec des produits de dégradation totalement métabolisables. Les études toxicologiques à long terme sont menées sur des périodes de 24 mois pour garantir l’innocuité des produits de dégradation, impliquant trois espèces animales différentes.
« Ce travail constitue une étape passionnante vers de nouvelles interfaces neuronales symbiotiques agissant au niveau des axones et des synapses individuels. Intégrées à des nanomatériaux conducteurs à l’échelle nanométrique 1 et 2, ces feuilles d’azobenzène sensibles à la lumière pourraient devenir une plateforme polyvalente permettant de détecter et de délivrer différents types de signaux (électriques, optiques, thermiques, etc.) aux neurones et à d’autres types de cellules de manière minimale ou non invasive. Bien que préliminaires, les données de cytocompatibilité rapportées dans ce travail sont également très prometteuses pour une utilisation future in vivo« , a commenté pour finir Flavia Vitale, professeur agrégé de neurologie, de bio-ingénierie et de médecine physique et de réadaptation à l’Université de Pennsylvanie, qui n’a pas été impliquée dans ce travail.
Légende illustration : Cette image montre les dispositifs de taille subcellulaire des chercheurs, qui sont conçus pour s’enrouler délicatement autour de différentes parties des neurones, telles que les axones et les dendrites, sans endommager les cellules. Ces dispositifs pourraient être utilisés pour mesurer ou moduler l’activité électrique d’un neurone. Image : Pablo Penso, © Marta Airaghi
Article : « Light-induced rolling of azobenzene polymer thin films for wrapping subcellular neuronal structures » – DOI : s42004-024-01335-8