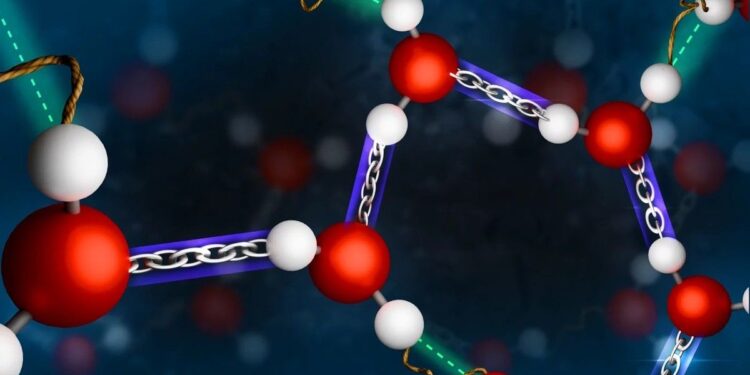
Les icebergs flottent sur l’eau liquide, l’eau froide à 4°C coule au fond : Avec ses anomalies, l’eau pose encore un certain nombre d’énigmes scientifiques. Des chercheurs dirigés par Johannes Hunger à l’Institut Max Planck pour la recherche sur les polymères ont étudié les liens entre une molécule d’eau et ses voisines dans la phase liquide. Ils ont découvert que les distances entre les molécules voisines ne sont pas distribuées au hasard : Les deux atomes d’hydrogène d’une molécule d’eau forment une liaison forte et une liaison faible avec les molécules voisines. Cette asymétrie moléculaire inhérente signifie que des superstructures telles que des anneaux ou des chaînes peuvent se former de manière transitoire – une clé pour une compréhension globale de la structure de l’eau liquide.
Les icebergs flottent sur l’eau parce que l’eau liquide sous-jacente a une densité supérieure à celle de l’iceberg. L’eau liquide elle-même a sa densité la plus élevée à 4°C. C’est l’une des anomalies de l’eau, c’est-à-dire des propriétés des liquides qui sont rarement observées pour d’autres liquides.
L’origine de ces anomalies fait depuis longtemps l’objet de recherches scientifiques. Des chercheurs de l’Institut Max Planck pour la recherche sur les polymères ont maintenant découvert une autre pièce du puzzle pour expliquer le comportement particulier de l’eau.
Les liaisons hydrogène, clé des propriétés de l’eau
Bon nombre des propriétés anormales de l’eau peuvent être attribuées aux interactions spéciales entre les molécules d’eau individuelles, appelées liaisons hydrogène. Chaque molécule d’eau peut donner deux de ces liaisons – une par atome d’hydrogène – et en accepter deux d’autres molécules voisines. Contrairement à la glace, ces liaisons sont rompues et reformées en moyenne mille milliards de fois par seconde dans l’eau liquide, ce qui permet aux molécules d’eau de se rapprocher les unes des autres et de se déplacer très rapidement. En raison du mouvement rapide des molécules d’eau dans le liquide, on pourrait supposer que la force des liaisons individuelles avec ses voisins est purement aléatoire.
Cependant, l’équipe dirigée par Johannes Hunger a découvert que les distances entre les liaisons hydrogène ne sont pas simplement aléatoires, mais que deux liaisons d’une molécule ont des forces différentes : si une liaison est très forte – c’est-à-dire que la première molécule d’eau voisine est très proche – la deuxième liaison hydrogène est faible – c’est-à-dire que la deuxième molécule d’eau voisine est plus éloignée.
Formation de structures moléculaires
Ces distances de liaison alternées conduisent à la structuration du liquide nominalement désordonné : si vous passez d’une molécule d’eau à la suivante et à celle d’après, il y a toujours une molécule voisine fortement liée. Par conséquent, des structures telles que des anneaux ou des chaînes de molécules d’eau peuvent se former dans le liquide. La structure de l’eau liquide n’est donc pas un simple arrangement aléatoire de molécules d’eau individuelles, mais suit certaines règles.
Pour obtenir ces résultats, les scientifiques ont dilué l’eau avec un solvant afin de pouvoir examiner des molécules d’eau isolées. Ils ont fait vibrer des atomes individuels des molécules d’eau à l’aide de lasers et ont étudié la manière dont les vibrations s’influencent mutuellement. Ils ont ainsi pu mesurer simultanément la force des liaisons hydrogène individuelles et la force de la liaison voisine.
Légende illustration : Les liaisons entre molécules d’eau voisines ne sont pas réparties de manière purement aléatoire : Chaque molécule d’eau forme une liaison forte et une liaison faible. Cela pourrait être une clé pour expliquer les anomalies de l’eau. Crédit : MPI-P
L’étude, qui vient d’être publiée dans la revue « Nature Communications », contribue à une compréhension globale des anomalies de l’eau au niveau moléculaire. ucas Gunkel, Amelie A. Ehrhard, Carola S. Krevert, Bogdan A. Marekha, Mischa Bonn, Maksim Grechko & Johannes Hunger Dynamic anti-correlations of water hydrogen bonds – Nature Communications | (2024) – DOI : 10.1038/s41467-024-54804-y