La production d’hydrogène est actuellement basée sur les propriétés catalytiques des métaux ‘nobles’ tels que le platine. Pour la première fois, les chercheurs du Laboratoire de chimie et biologie des métaux (CEA-CNRS-Université Joseph Fourier, au CEA de Grenoble) sont parvenus à produire de l’hydrogène en utilisant un ensemble moléculaire sans recourir à un catalyseur à base de métal noble.
Ce résultat, important pour l’avenir économique de la filière hydrogène, fait l’objet d’une publication dans la revue Angewandte Chemie International Edition du 4 janvier.
Les recherches menées pour améliorer la production d’hydrogène s’inspirent, pour une large part, des réactions chimiques intervenant dans la photosynthèse chez les végétaux. En effet, sous l’effet de la lumière, certains micro-organismes produisent de l’hydrogène à partir de l’eau. Pour reproduire et adapter ces processus, les chercheurs ont mis au point des systèmes moléculaires capables de capter l’énergie lumineuse – fonction de photosensibilisateur – et d’utiliser l’énergie collectée pour libérer l’hydrogène de l’eau – fonction de catalyseur.
Actuellement, tous les dispositifs technologiques développés pour produire ou utiliser l’hydrogène renferment des métaux nobles[1] tels que le platine. Or, les réserves en platine sont limitées. La rareté et le coût de ce métal sont des freins au développement économique de la filière hydrogène sur le long terme, et ce malgré les efforts pour réduire les quantités utilisées dans les électrolyseurs et les piles.

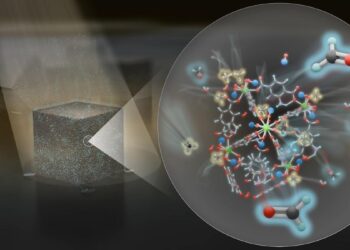
Des recherches sont donc menées afin de ne plus avoir recours au platine, en élaborant des catalyseurs à base de métaux naturellement plus abondants et moins chers, tels que ceux utilisés par les organismes naturels (fer, nickel, cobalt, manganèse). Un nouveau système vient donc d’être mis au point utilisant un catalyseur à base de cobalt. Il s’agit d’un système supramoléculaire qui assure à la fois la fonction de photosensibilisateur et de catalyseur.
Sous l’effet de la lumière, les électrons fournis par une molécule organique sont utilisés pour libérer l’hydrogène de l’eau au niveau du cobalt, avec une efficacité supérieure aux systèmes comparables renfermant des catalyseurs à base de métaux nobles (Pd, Rh et Pt). La fonction de photosensibilisateur reste assurée par l’utilisation de ruthénium (Ru, partie gauche du schéma) ; une prochaine étape de ces recherches visera à s’en affranchir.
Si l’objectif ultime de ces recherches demeure l’utilisation de l’eau comme source de protons et d’électrons (évitant ainsi d’avoir à ajouter une molécule organique), les travaux publiés constituent une avancée considérable dans le domaine de la photo-production d’hydrogène.
[1] Historiquement, les métaux nobles étaient les métaux précieux (or, argent, platine) utilisés en orfèvrerie. Cela correspond pour le chimiste à des métaux qui ne s’oxydent pas facilement. Ce terme s’applique maintenant aux autres métaux qui présentent une faible abondance dans la croûte terrestre et sont donc à la fois rares et coûteux (palladium, rhodium, iridium, osmium et ruthénium).
Pour en savoir plus :