Des chercheurs du MIT ont conçu un électrolyte qui peut se décomposer à la fin de la vie d’une batterie, ce qui facilite le recyclage des composants.
Le boom actuel des véhicules électriques est la montagne de déchets électroniques de demain. Et bien que de nombreux efforts soient déployés pour améliorer le recyclage des batteries, beaucoup d’entre elles finissent encore dans des décharges.
Une équipe de recherche du MIT souhaite contribuer à changer cela grâce à un nouveau type de matériau auto-assemblé pour batteries qui se décompose rapidement lorsqu’il est immergé dans un simple liquide organique. Dans un nouvel article publié dans Nature Chemistry, les chercheurs ont montré que ce matériau peut fonctionner comme électrolyte dans une cellule de batterie à semi-conducteurs opérationnelle, puis revenir à ses composants moléculaires d’origine en quelques minutes.
Cette approche offre une alternative au broyage de la batterie en une masse hétérogène difficile à recycler. Au contraire, comme l’électrolyte sert de couche de connexion de la batterie, lorsque le nouveau matériau reprend sa forme moléculaire d’origine, la batterie entière se désassemble pour accélérer le processus de recyclage.
« Jusqu’à présent, dans l’industrie des batteries, nous nous sommes concentrés sur des matériaux et des conceptions hautement performants, et ce n’est que plus tard que nous avons essayé de trouver comment recycler les batteries fabriquées avec des structures complexes et des matériaux difficiles à recycler », indique le premier auteur de l’article, Yukio Cho, docteur en 2023. « Notre approche consiste à partir de matériaux facilement recyclables et à trouver comment les rendre compatibles avec les batteries. Concevoir des batteries recyclables dès le départ est une nouvelle approche. »
Outre M. Cho, ont également participé à la rédaction de cet article Cole Fincher, doctorant, Ty Christoff-Tempesta, docteur en 2022, Yet-Ming Chiang, professeur Kyocera de céramique, Julia Ortony, professeure associée invitée, Xiaobing Zuo et Guillaume Lamour.

De meilleures batteries
Dans l’un des films « Harry Potter », il y a une scène où le professeur Dumbledore nettoie une maison délabrée d’un simple geste de la main et d’un sortilège. Cho raconte que cette image l’a marqué lorsqu’il était enfant. (Quelle meilleure façon de nettoyer sa chambre ?) Lorsqu’il a assisté à une conférence d’Ortony sur l’ingénierie moléculaire permettant d’assembler des molécules pour former des structures complexes, puis de les ramener à leur forme d’origine, il s’est demandé si cela pouvait être utilisé pour faire fonctionner le recyclage des batteries comme par magie.
Ce serait un changement de paradigme pour l’industrie des batteries. Aujourd’hui, le recyclage des batteries nécessite des produits chimiques agressifs, une chaleur élevée et un traitement complexe. Une batterie se compose de trois parties principales : la cathode chargée positivement, l’électrode chargée négativement et l’électrolyte qui transporte les ions lithium entre les deux. Les électrolytes de la plupart des batteries lithium-ion sont hautement inflammables et se dégradent avec le temps en sous-produits toxiques qui nécessitent une manipulation spécialisée.
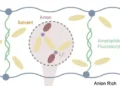
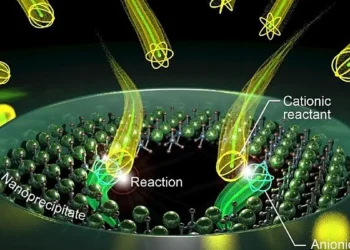
Afin de simplifier le processus de recyclage, les chercheurs ont décidé de créer un électrolyte plus durable. Pour cela, ils se sont tournés vers une classe de molécules qui s’auto-assemblent dans l’eau, appelées amphiphiles aramides (AA), dont la structure chimique et la stabilité imitent celles du Kevlar. Les chercheurs ont ensuite conçu les AA de manière à ce qu’elles contiennent du polyéthylène glycol (PEG), qui peut conduire les ions lithium, à une extrémité de chaque molécule. Lorsque les molécules sont exposées à l’eau, elles forment spontanément des nanorubans avec des surfaces et des bases en PEG conductrices d’ions qui imitent la robustesse du Kevlar grâce à des liaisons hydrogène étroites. Il en résulte une structure nanoruban mécaniquement stable qui conduit les ions à travers sa surface.
« Le matériau est composé de deux parties », ajoute Cho. « La première partie est cette chaîne flexible qui nous donne un nid, ou un hôte, dans lequel les ions lithium peuvent se déplacer. La deuxième partie est ce composant organique solide utilisé dans le Kevlar, qui est un matériau pare-balles. Ceux-ci rendent l’ensemble de la structure stable. »
Lorsqu’ils sont ajoutés à l’eau, les nanorubans s’assemblent d’eux-mêmes pour former des millions de nanorubans qui peuvent être pressés à chaud pour former un matériau à l’état solide.
« Dans les cinq minutes qui suivent son ajout à l’eau, la solution devient gélatineuse, ce qui indique qu’il y a tellement de nanofibres formées dans le liquide qu’elles commencent à s’entremêler », explique M. Cho. « Ce qui est passionnant, c’est que nous pouvons fabriquer ce matériau à grande échelle grâce à son comportement d’auto-assemblage. »
L’équipe a testé la résistance et la dureté du matériau et a constaté qu’il pouvait supporter les contraintes liées à la fabrication et au fonctionnement de la batterie. Elle a également construit une cellule de batterie à l’état solide utilisant du phosphate de fer lithié pour la cathode et de l’oxyde de titane lithié pour l’anode, deux matériaux couramment utilisés dans les batteries actuelles. Les nanorubans ont permis de transférer avec succès les ions lithium entre les électrodes, mais un effet secondaire appelé polarisation a limité le mouvement des ions lithium vers les électrodes de la batterie lors des cycles rapides de charge et de décharge, ce qui a nui à ses performances par rapport aux batteries commerciales actuelles, considérées comme la référence en la matière.
« Les ions lithium se déplaçaient correctement le long de la nanofibre, mais le transfert des ions lithium des nanofibres vers l’oxyde métallique semblait être le point le plus lent du processus », observe M. Cho.
Lorsqu’ils ont immergé la cellule de batterie dans des solvants organiques, le matériau s’est immédiatement dissous, chaque partie de la batterie se détachant pour faciliter le recyclage. M. Cho a comparé la réaction des matériaux à celle de la barbe à papa immergée dans l’eau.
« L’électrolyte maintient les deux électrodes de la batterie ensemble et fournit les voies de passage des ions lithium », dit encore M. Cho. « Ainsi, lorsque vous souhaitez recycler la batterie, toute la couche d’électrolyte peut se détacher naturellement et vous pouvez recycler les électrodes séparément. »
Validation d’une nouvelle approche
Selon M. Cho, ce matériau est une preuve de concept qui démontre l’efficacité de l’approche axée sur le recyclage.
« Nous ne voulons pas dire que nous avons résolu tous les problèmes avec ce matériau. Les performances de notre batterie n’étaient pas fantastiques, car nous avons utilisé uniquement ce matériau comme électrolyte pour le papier, mais nous envisageons d’utiliser ce matériau comme une couche dans l’électrolyte de la batterie. Il n’est pas nécessaire qu’il s’agisse de l’électrolyte complet pour lancer le processus de recyclage. »
M. Cho estime également qu’il existe une grande marge d’optimisation des performances du matériau grâce à des expériences supplémentaires.
À présent, les chercheurs explorent des moyens d’intégrer ce type de matériaux dans les conceptions de batteries existantes et de mettre en œuvre ces idées dans de nouvelles compositions chimiques pour batteries.
« Il est très difficile de convaincre les fournisseurs existants de changer radicalement leurs pratiques. Mais avec les nouveaux matériaux pour batteries qui pourraient apparaître dans cinq ou dix ans, il pourrait être plus facile de les intégrer dès le départ dans de nouvelles conceptions. »
M. Cho estime également que cette approche pourrait contribuer à relocaliser l’approvisionnement en lithium en réutilisant les matériaux provenant de batteries déjà présentes aux États-Unis.
« Les gens commencent à réaliser à quel point c’est important. Si nous pouvons commencer à recycler à grande échelle les batteries lithium-ion issues des déchets de batteries, cela aura le même effet que l’ouverture de mines de lithium aux États-Unis. De plus, chaque batterie nécessite une certaine quantité de lithium. Si l’on extrapole la croissance des véhicules électriques, nous devons réutiliser ce matériau pour éviter des hausses massives du prix du lithium. »
Source : « Reversible self-assembly of small molecules for recyclable solid-state battery electrolytes » – DOI : 10.1038/s41557-025-01917-6
Source : MIT