Imaginez une voiture électrique qui pourrait parcourir 600, 700 voire 1000 miles (soit 1600 km) avec une seule charge. C’est bien plus que l’autonomie maximale des véhicules électriques sur le marché américain, selon le magazine Car and Driver – et le double de l’autonomie officielle de la Tesla Model 3 longue autonomie à traction arrière, dont l’autonomie maximale est estimée à 363 miles.
Les véhicules électriques actuels utilisent des batteries lithium-ion, qu’on trouve aussi dans les smartphones, les ordinateurs portables et même les systèmes de stockage d’énergie à grande échelle connectés au réseau électrique. Établi depuis des décennies, ce type de batterie a été ajusté et amélioré par des générations de scientifiques et est désormais proche de ses limites physiques. Même avec les meilleurs matériaux et les conceptions les plus optimisées, il n’y a qu’une quantité limitée d’énergie que l’on peut emmagasiner dans une batterie lithium-ion.
Je suis une ingénieure en matériaux qui étudie ces batteries et recherche des alternatives offrant de meilleures performances, une durabilité environnementale améliorée et un coût réduit. Une conception prometteuse utilise le soufre, ce qui pourrait augmenter considérablement la capacité des batteries, bien que des obstacles clés subsistent avant une utilisation généralisée.
Lithium-soufre contre lithium-ion
Toute batterie possède trois composants de base : une région chargée positivement, appelée cathode ; une région chargée négativement, appelée anode ; et une substance appelée électrolyte entre les deux, à travers laquelle les atomes chargés, aussi appelés ions, se déplacent entre la cathode et l’anode.
Dans une batterie lithium-ion, la cathode est constituée d’un oxyde métallique, contenant généralement des métaux comme le nickel, le manganèse et le cobalt, liés à l’oxygène. Les matériaux sont stratifiés, avec des ions lithium physiquement intercalés entre les couches. Pendant la charge, les ions lithium se détachent du matériau cathodique stratifié et voyagent à travers l’électrolyte jusqu’à l’anode.
L’anode est généralement en graphite, qui est également stratifié, avec de l’espace pour que les ions lithium s’insèrent entre les couches. Pendant la décharge, les ions lithium quittent les couches de graphite, retournent à travers l’électrolyte et se réinsèrent dans la structure stratifiée de la cathode, se recombinant avec l’oxyde métallique pour libérer de l’électricité qui alimente les voitures et les smartphones.
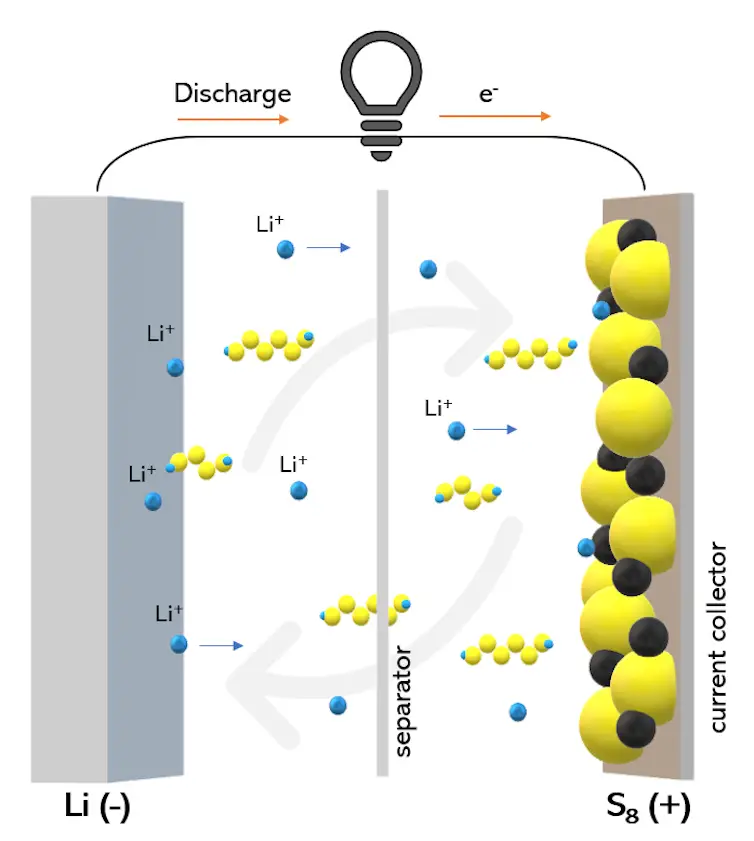
Dans une batterie lithium-soufre, les ions lithium se déplacent toujours d’avant en arrière, mais la chimie est différente. Sa cathode est constituée de soufre intégré dans une matrice de carbone qui conduit l’électricité, et l’anode est principalement constituée de lithium lui-même, plutôt que de couches de graphite avec du lithium intercalé.
Pendant la décharge, les ions lithium voyagent de l’anode, à travers l’électrolyte, jusqu’à la cathode, où – au lieu de glisser entre les couches de la cathode – ils convertissent chimiquement le soufre en une série de composés appelés sulfures de lithium, par étapes séquentielles. Pendant la charge, les ions lithium se séparent des composés sulfurés, quittent la cathode et retournent à l’anode.
Le processus de charge et de décharge des batteries lithium-soufre est une réaction de conversion chimique qui implique plus d’électrons que le même processus dans les batteries lithium-ion. Cela signifie qu’une batterie lithium-soufre peut théoriquement stocker beaucoup plus d’énergie qu’une batterie lithium-ion de même taille.
Le soufre est peu coûteux et abondant dans le monde entier, ce qui signifie que les fabricants de batteries n’ont pas besoin de dépendre de métaux rares comme le nickel et le cobalt, qui sont répartis inégalement sur Terre et souvent sourcés dans des régions comme la République démocratique du Congo, où il existe des règlementations limitées en matière de sécurité des travailleurs et de pratiques de travail équitables.
Ces avantages pourraient aboutir à des batteries ayant une capacité bien supérieure, moins chères et plus durables à produire.
Pourquoi les batteries lithium-soufre ne sont-elles pas encore largement utilisées ?
Le plus grand obstacle à la production et à l’utilisation massives des batteries au soufre est la durabilité. Une bonne batterie lithium-ion, comme celles d’un véhicule électrique, peut passer par des milliers de cycles de décharge et de recharge avant que sa capacité ne commence à diminuer. Cela équivaut à des milliers de trajets en voiture.
Mais les batteries lithium-soufre ont tendance à perdre leur capacité beaucoup plus rapidement, parfois après moins de 100 cycles. Ce n’est pas beaucoup de trajets du tout.
La raison réside dans la chimie. Pendant les réactions chimiques qui stockent et libèrent l’énergie dans une batterie lithium-soufre, certains des composés de sulfure de lithium se dissolvent dans l’électrolyte liquide de la batterie.
Lorsque cela se produit, ces quantités de soufre et de lithium sont retirées et ne peuvent plus être utilisées dans les réactions restantes. Cet effet, appelé « shuttling » (navette), signifie qu’à chaque cycle de décharge et de recharge, il y a moins d’éléments disponibles pour libérer et stocker l’énergie.
Au cours des deux dernières décennies, la recherche a produit des conceptions améliorées. Les versions antérieures de ces batteries perdaient une grande partie de leur capacité en quelques dizaines de cycles de décharge-recharge, et même les meilleurs prototypes de laboratoire peinaient à dépasser quelques centaines de cycles.
Les nouveaux prototypes conservent plus de 80% de leur capacité initiale même après des milliers de cycles. Cette amélioration provient d’une reconception des parties clés de la batterie et d’un ajustement des produits chimiques impliqués : des électrolytes spéciaux aident à empêcher la dissolution et le « navettage » des sulfures de lithium.
Les électrodes ont également été améliorées, en utilisant des matériaux comme le carbone poreux qui peuvent piéger physiquement les sulfures de lithium intermédiaires, les empêchant de s’éloigner de la cathode. Cela aide les réactions de décharge et de recharge à se produire avec moins de pertes, rendant les réactions plus efficaces et la batterie plus durable.
La route à suivre
Les batteries lithium-soufre ne sont plus des curiosités de laboratoire fragiles, mais des défis importants subsistent avant qu’elles ne puissent devenir des concurrentes sérieuses pour le stockage d’énergie dans le monde réel.
En termes de sécurité, les batteries lithium-soufre ont une cathode moins volatile que les batteries lithium-ion, mais la recherche se poursuit sur d’autres aspects de la sécurité.
Un autre problème est que plus une batterie lithium-soufre stocke d’énergie, moins elle peut supporter de cycles de charge. C’est parce que les réactions chimiques impliquées sont plus intenses avec l’augmentation de l’énergie.
Ce compromis peut ne pas être un obstacle majeur pour l’utilisation de ces batteries dans les drones ou le stockage d’énergie au niveau du réseau, où les densités d’énergie ultra-élevées sont moins critiques. Mais pour les véhicules électriques, qui exigent à la fois une capacité énergétique élevée et une longue durée de vie, les scientifiques et les chercheurs en batteries doivent encore trouver un équilibre viable. Cela signifie que les fondations de la prochaine génération de batteries lithium-soufre sont probablement encore à quelques années.
Golareh Jalilvand, professeure adjointe en génie chimique, University of South Carolina
Cet article est republié de The Conversation sous licence Creative Commons. Lire l’article original.