Dario Rangel Shaw | Krishna Katuri
De nouvelles voies de transfert d’électrons découvertes chez Desulfobacterota révèlent une polyvalence microbienne et un potentiel énergétique surprenants.
Les microbes sont passés maîtres dans l’art de la survie, développant des stratégies ingénieuses pour capter l’énergie de leur environnement. Pendant des décennies, les scientifiques ont cru que seules quelques bactéries utilisaient des « circuits » moléculaires spécialisés pour transporter des électrons à l’extérieur de leurs cellules, un processus connu sous le nom de transfert extracellulaire d’électrons (EET). Ce mécanisme est essentiel au cycle du carbone, du soufre, de l’azote et des métaux dans la nature, et il est à la base d’applications allant du traitement des eaux usées à la bioénergie et aux matériaux bioélectroniques.
Aujourd’hui, les chercheurs de la KAUST ont découvert que cette capacité remarquable est bien plus polyvalente et répandue qu’on ne l’imaginait auparavant.
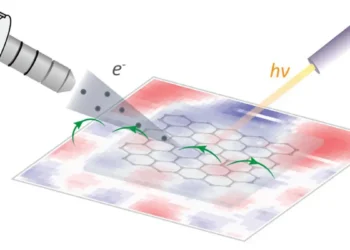
En travaillant avec Desulfuromonas acetexigens, une bactérie capable de générer des courants électriques élevés, l’équipe a combiné la bioélectrochimie, la génomique, la transcriptomique et la protéomique pour cartographier son mécanisme de transfert d’électrons. À leur grande surprise, D. acetexigens a activé simultanément trois voies distinctes de transfert d’électrons que l’on pensait auparavant avoir évolué séparément dans des microbes non apparentés : les systèmes de réduction des métaux (Mtr), de cytochrome de membrane externe (Omc) et de porine-cytochrome (Pcc).
« C’est la première fois que nous voyons un seul organisme exprimer ces voies phylogénétiquement éloignées en parallèle », précise le premier auteur, Dario Rangel Shaw. « Cela remet en question l’idée longtemps admise selon laquelle ces systèmes étaient exclusifs à des groupes microbiens spécifiques. »
L’équipe a également identifié des cytochromes inhabituellement grands, dont un avec un nombre record de 86 motifs de liaison à l’hème, qui pourraient permettre un transfert d’électrons et une capacité de stockage exceptionnels. Des tests ont montré que la bactérie pouvait canaliser les électrons directement vers des électrodes et des minéraux ferreux naturels, atteignant des densités de courant comparables à celles de l’espèce modèle Geobacter sulfurreducens.
En étendant leur analyse aux génomes accessibles au public, les chercheurs ont identifié plus de 40 espèces de Desulfobacterota portant des systèmes multipathways similaires dans divers environnements, des sédiments et sols aux eaux usées et cheminées hydrothermales.
« Cela révèle une polyvalence méconnue de la respiration microbienne », ajoute Krishna Katuri, coauteur de l’étude. « Les microbes dotés de multiples voies de transfert d’électrons peuvent acquérir un avantage concurrentiel en exploitant un plus large éventail d’accepteurs d’électrons dans la nature. »
Les implications vont bien au-delà de l’écologie. L’exploitation de bactéries capables d’utiliser plusieurs stratégies de transfert d’électrons pourrait accélérer les innovations dans les domaines de la bioremédiation, du traitement des eaux usées, de la production de bioénergie et de la bioélectronique. Par exemple, les biofilms électroactifs tels que ceux formés par D. acetexigens pourraient aider à récupérer l’énergie des flux de déchets tout en traitant simultanément les polluants.
« Nos découvertes élargissent la diversité connue des protéines de transfert d’électrons et mettent en évidence des ressources microbiennes inexploitées », ajoute Pascal Saikaly, qui a dirigé l’étude. « Cela ouvre la voie à la conception de systèmes microbiens plus efficaces pour des biotechnologies durables. »
Alors que les chercheurs approfondissent leurs recherches sur le monde microbien, la découverte qu’une seule bactérie peut utiliser plusieurs voies souligne tout ce qui reste à explorer et comment ces stratégies cachées pourraient contribuer à un avenir plus propre et plus durable.
Shaw D.R., Katuri K.P., Sapireddy V., Douvropoulou O., Gralnick J.A., Saikaly P.E. Independently evolved extracellular electron transfer pathways in ecologically diverse Desulfobacterota. The ISME Journal, 19, wraf097 (2025). | DOI.
Source : Kaust