La demande en batteries pour stocker les énergies renouvelables va croître massivement. Pouvons-nous en concevoir qui impactent moins l’environnement et préservent mieux nos ressources que les batteries lithium-ion ?
L’économie mondiale exige de plus en plus de batteries au lithium-ion. Les voitures électriques en dépendent, tout comme les ordinateurs portables, les smartphones et les outils électriques pour les secteurs de la construction et du bricolage. Bientôt, un autre domaine qui nécessite des batteries rechargeables à grande échelle émergera: le stockage d’énergie renouvelable qui ne peut pas être utilisée directement. Les quantités croissantes d’électricité verte temporairement disponibles ne peuvent plus être stockées dans les seules centrales à pompage-turbinage car le réseau électrique surchargé ne le permet guère. La demande de batteries stationnaires à faible coût va donc augmenter fortement. Elles doivent également être fabriquées à partir de matériaux respectueux de l’environnement, dans la mesure du possible, afin de ne pas épuiser davantage les réserves mondiales de lithium et de cobalt – ces substances sont contenues dans les batteries lithium-ion.
Kostiantyn Kravchyk et Maksym Kovalenko, chercheurs de l’Empa et de l’ETH Zurich, ont examiné de plus près les alternatives possibles aux batteries lithium-ion. Ils ont étudié des dizaines de publications de groupes de recherche du monde entier et ont systématiquement mené leurs propres expériences. Leurs évaluations ont été publiées au début de l’année dans le New Journal of Chemistry, entre autres.
Loin du Lithium – vers le Sodium ?
L’une des idées les plus simples serait de remplacer le lithium par du sodium. C’est tout sauf rare : le chlorure de sodium se trouve dans l’eau de mer et est accessible partout dans le monde. Mais les avantages sont limités. Comme un ion sodium est environ 50 % plus grand qu’un ion lithium, les matériaux de la cathode sont électrochimiquement moins stables. Par exemple, l’oxyde de sodium-cobalt (qui correspond à l’oxyde de lithium-cobalt d’une batterie lithium-ion standard) peut supporter beaucoup moins de cycles de charge. Cela élimine l’idée d’un coût avantageux. Il y a également des problèmes du côté opposé de la batterie, avec le matériau de l’anode. Le graphite (comme dans la batterie lithium-ion) est inutile pour les batteries au sodium car il stocke trop peu d’ions sodium. Des expériences avec de l’étain, de l’antimoine ou du phosphore bon marché ont montré de bons résultats dans le stockage des charges électriques, mais lors de la charge, l’anode gonfle jusqu’à avoir trois fois son volume d’origine. Cela nuit à la stabilité mécanique: en cas de choc, le matériau gonflé peut facilement se désintégrer et la batterie serait endommagée. Avec les anodes de phosphore, il y a un problème encore plus grave: lors de la charge, du phosphure de sodium (Na3P7) se forme dans l’anode, qui, avec l’eau, produit du monophosphane, un gaz extrêmement toxique qui entraîne une insuffisance respiratoire. Les phosphures métalliques, qui sont utilisés comme raticide, agissent de la même manière. Presque personne ne voudrait avoir une telle batterie, entièrement chargée à l’énergie solaire, dans sa cave.
Et le magnésium ?
Le magnésium suit le sodium dans le tableau périodique chimique. Il s’agit d’un petit atome léger qui peut transférer deux électrons à la fois. Le magnésium est bon marché et non toxique. Pourrait-on l’utiliser pour fabriquer des piles ? Du côté de l’anode de la batterie, le magnésium présente en effet des avantages: Vous n’avez pas besoin de graphite (comme dans les batteries lithium-ion), mais vous pouvez utiliser directement du magnésium métallique comme anode. Mais le petit ion de magnésium à double charge présente des inconvénients du côté de la cathode. La charge électrique élevée sur un petit diamètre entraîne des forces d’attraction électrique élevées. Par exemple, l’ion ne se glisse dans un réseau d’oxyde de cobalt qu’avec une grande force, et s’il y est coincé, il est difficile de le faire sortir à nouveau. Quiconque tente de le faire par la force – c’est-à-dire avec des tensions plus élevées – risque de déclencher des processus d’oxydation et de réduction des composants chimiques de la batterie, et donc de les détruire. Ces piles ne se chargent donc pas rapidement et ne peuvent être utilisées que dans une plage de tension réduite si elles doivent durer longtemps.
Adieu au «Rocking Chair»
Si vous faites un pas de plus vers la droite dans le tableau périodique du magnésium, vous vous retrouvez avec de l’aluminium. Ce métal est également disponible en grande quantité, il est non toxique et bon marché. Il peut transférer trois électrons. Comme la pile au magnésium, l’anode est facile à fabriquer ; une feuille d’aluminium suffit. Cependant, le reste d’une batterie en aluminium fonctionne de manière fondamentalement différente d’une batterie au lithium-ion: les batteries au lithium-ion sont connues sous le nom de rocking chairs. Lors de la décharge, les ions de lithium se déplacent de l’anode à la cathode, lors de la charge, ils reviennent. En revanche, dans une pile en aluminium, les ions d’aluminium ne migrent pas directement entre l’anode et la cathode. Au lieu de cela, les composants du fluide électrolytique sont «consommés» par les deux électrodes pendant la charge. D’une part, l’électrolyte fournit de l’aluminium, qui est déposé sur l’anode sous forme de métal. De l’autre côté de la batterie, les ions AlCl4- sont extraits du liquide d’électrolyte et déposés dans l’anode en graphite. La quantité d’électrolyte disponible est donc déterminante pour la capacité de la batterie. En raison de ce principe fonctionnel chimique, une batterie aluminium-graphite sera toujours environ cinq fois plus lourde qu’une batterie lithium-ion comparable. En outre, il existe un autre problème : la cathode en graphite se dilate jusqu’à plus de deux fois son volume initial lors de chaque processus de charge et se contracte à nouveau lorsqu’elle est déchargée. Cela signifie que ces piles ont besoin d’une enveloppe extérieure souple et d’un boîtier de protection offrant suffisamment d’espace pour «respirer». L’inflation et le rétrécissement ont un effet négatif sur la résistance aux vibrations et la stabilité à long terme. De nouvelles solutions de conception sont nécessaires dans ce domaine.
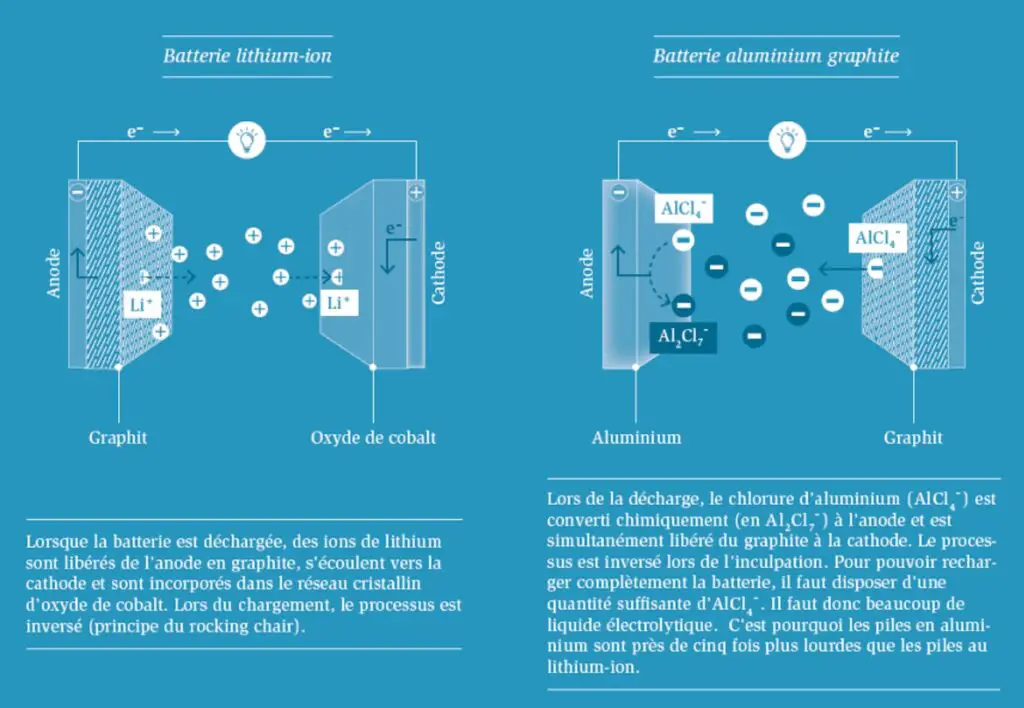
Nouvelle gestion des batteries
L’algorithme de charge de ces batteries non lithium-ion constitue un défi supplémentaire. Le groupe de recherche dirigé par Kravchyk et Kovalenko a découvert que la performance d’une électrode en aluminium graphite pouvait être augmentée jusqu’à 25 % grâce à une charge intelligente et progressive. Un groupe de recherche travaillant à Taïwan, en Chine, aux États-Unis et en Allemagne a découvert que ces électrodes sont nettement plus efficaces lorsqu’elles sont refroidies à –10 degrés Celsius. Ces résultats montrent clairement qu’un tout nouveau système de gestion des batteries, c’est-à-dire de nouveaux capteurs, chargeurs et algorithmes, doit être mis au point pour des batteries chimiquement complètement différentes. On ne sait pas encore très bien laquelle des technologies de batteries décrites ici prévaudra et pourra remplacer les batteries lithium-ion dans certains domaines. Dans leur analyse, les chercheurs soulignent également qu’aucune des technologies présentées ne peut rivaliser avec les batteries lithium-ion en termes de densité énergétique. Il est très probable que cela restera le cas à l’avenir. Ces piles alternatives ne sont donc concevables que pour des applications dans lesquelles l’électricité doit être stockée à un coût aussi bas que possible et où l’accent est mis sur une production écologique de piles.
Recherche plus orientée vers les applications
Il reste donc beaucoup à faire pour les groupes de recherche du monde entier avant que les piles alternatives ne fassent une percée. Kostiantyn Kravchyk et Maksym Kovalenko souhaitent une approche plus holistique. « Dans le monde de la recherche, une expérience ne fait souvent que prouver la faisabilité d’une idée – le coût de tous les composants nécessaires et le poids total estimé du système complet de batteries, en revanche, sont souvent négligés », explique M. Kravchyk. Mais ce sont précisément ces paramètres qui sont décisifs pour une éventuelle commercialisation. « Ils devraient donc être davantage pris en compte dans les travaux de recherche que ce n’est le cas jusqu’à présent ».
Malgré cette étude quelque peu décevante, Kostiantyn Kravchyk continuera à l’avenir à faire des recherches sur les piles de rechange. «Les systèmes utilisant le graphite comme cathode continueront à être très intéressants. Nous avons déjà pu montrer que le gonflement et le rétrécissement du matériau de la cathode est également un problème qui peut être surmonté. «Avec ses collègues, il fait actuellement des recherches sur des électrodes en graphite «semi-solide» qui sont durables et peuvent en même temps bien transmettre l’électricité.
Auteur : RAINER KLOSE











La commission électrotechnique internationale qui normalise, entre autres, le vocabulaire touchant par exemple les générateurs électrochimiques, a fixé le terme de positive et de négative pour les deux électrodes. La commission a son siège en Suisse, là où est l’ETH. Mis à part cette question de vocabulaire, l’étude est correcte. En France, JM Tarascon du Collège de France l’a publiée il y a quelques années déjà. Une question: et les batteries redox à circulation, pourquoi ne pas les citer?